Сельскохозяйственная биология, 2008, № 6, С. 16-24.
На основании данных зарубежных и ряда отечественных авторов рассматриваются цитогенетические характеристики, системы групп крови и полиморфных белков крови, полиморфные системы белков молока, других тканей, полиморфизм ДНК (аллели генов гистосовместимости, митохондриальная ДНК, микросателлитные последовательности), а также приведены данные о наследственных заболеваниях и аномалиях у лосей.
Ключевые слова: генетика, биоразнообразие, виды, гены, генетические маркеры.
Лосеводство — сравнительно новая отрасль животноводства, не получившая пока широкого распространения. Развитие лосеводства может осуществляться за счет реализации генетического потенциала лосей, в первую очередь одомашниваемых особей.
Основными селекционными признаками в работе по одомашниванию лосей признаны величина удоя за лактацию, содержание жира и белка в молоке, живая масса, выраженность молочного или мясного типа телосложения, морфологические и физиологические особенности вымени, устойчивость к заболеваниям, привязанность к человеку и пр. Большинство этих признаков имеют полигенный характер наследования, поэтому их генетический анализ должен осуществляться на основе фенотипических показателей с использованием приемов и методов популяционной генетики, математической статистики, иммуно- и цитогенетики.
Цитогенетическая характеристика. При изучении кариотипов лосей из северо-восточной Азии (1) были обнаружены две хромосомные формы: европейский лось (2n = 68), обитающий в Европе и Западной Сибири, и американский (2n = 70), обитающий в Северной Америке, на Дальнем Востоке и в Восточной Сибири. Существование двух форм подтверждено данными об их морфологии, звуковых сигналах, электрофоретической подвижности белков и различиях в характере питания. Изучение четырех особей из разных областей Республики Саха выявило по 70 хромосом в кариотипе, в чем проявляется родство с американской формой (2). Существует мнение, что долгосрочная изоляция европейских и американских лосей привела к сильному расхождению между этими формами и, следовательно, они могут считаться разными видами (2).
Характеристика по группам крови. В 1977-1982 годах в совместных исследованиях лаборатории лосеводства Костромской ГОСХОС (ныне Костромской НИИ сельского хозяйства — КНИИСХ), лаборатории иммуногенетики Костромского СХИ (ныне Костромская государственная сельскохозяйственная академия — КГСХА) и лаборатории генетики животных Всероссийского НИИ животноводства (ВИЖ) были определены эритроцитарные антигены (ЕА) у 19 одомашниваемых лосей (3). Постановку реакции гемолиза по определению ЕА проводили с использованием 70 стандартных сывороток крупного рогатого скота (КРС) по 8 из 12 известных генетических систем: A (3 реагента), B (40 реагентов), C (10 реагентов), FV (2 реагента), J, L, M, S (7 реагентов). С 68 стандартными сыворотками реакций не обнаружили. Во всех образцах при использовании W-сыворотки (C-система ЕА КРС) через 4 ч после постановки реакции наблюдали полный гемолиз (4 балла) (4). У 8 особей была зарегистрирована реакция гемолиза с сывороткой G2 (B-система КРС). Перекрестные гемолитические реакции (эритроциты лося с нормальной сывороткой КРС и эритроциты лося с сывороткой лося) дали отрицательный результат. На этом основании был сделан вывод о специфичности эритроцитарных антигенов, вступивших в реакцию с двумя стандартными сыворотками КРС у обследованных лосей (3): W-антиген C-системы является видовым, а G2-антиген B-системы — групповым.
В продолжившихся исследованиях (1983-1988 годы) изучали полиморфизм эритроцитарных антигенов у 7 одомашниваемых лосих (5), используя 47 стандартных сывороток КРС по 9 генетическим системам. С 28 реагентами реакцию не выявили. Достоверный гемолиз (3-4 балла) (4) отмечен только с реагентами систем В (P2, Q, T2, O?), С (W, L?), FV (V), J, S (U?).
Полиморфные системы белков крови. Самые ранние сведения по этому вопросу относятся к 1962 году, когда M. Braend выявил у 27 особей норвежских лосей (Alcesalces) отсутствие полиморфизма по основным сывороточным белкам (6).
При электрофорезе в крахмальном геле в сыворотке крови одомашненных европейских лосей (Alcesalces) из Печоро-Илычского государственного заповедника также было обнаружено отсутствие индивидуального полиморфизма по трансферриновому локусу (7). На электрофореграммах всех образцов имелись три белковые фракции с промежуточной подвижностью между постальбуминами и медленными a-глобулинами. Ведущая по скорости миграции полоса была окрашена умеренно, следующая — интенсивно, последняя — очень слабо. После 25 сут хранения сыворотки при +4 °С третья полоса, как правило, не выявлялась.
Для контроля относительного положения трансферриновых зон электрофорез образцов сыворотки крови европейского лося проводился одновременно с образцами, полученными от КРС. В образцах, принадлежащих лосям, индивидуальные различия между особями не проявились, однако, согласно представленным данным, обнаруженные зоны по электрофоретической подвижности аналогичны двум вариантам трансферрина КРС (TF C и TF D).
Низкая степень полиморфизма некоторых эритроцитарных и сывороточных белков (гемоглобина HB, альбумина ALB, изоэнзимов амилазы AMY1 и AMY2, церулоплазмина CP) выявлена у европейских лосей (8).
Электрофорезом в крахмальном геле показано, что гемоглобин европейского лося мономорфен и по свойствам близок к HB B КРС. Это характерно для животных из равнинных зон. Аминокислотная последовательность гемоглобина определена (9). Альбумин сыворотки крови также мономорфен, однако при этом подвижность белка выше, чем у вариантов альбумина A и B КРС. Видимо, альбумин у лося обладает специфическими свойствами, позволяющими в естественных условиях быстро регулировать осмотическое давление крови.
При разделении генетических вариантов AMY1 методом электрофореза в крахмальном геле амилаза 1 сыворотки крови лосей проявлялась на зимограмме в виде одной зоны энзиматической активности, соответствующей аллелозиму AMY1 С КРС. При исследовании 12 образцов сыворотки крови лосей не было обнаружено индивидуальных вариаций в изоферментном спектре AMY2. Выявленные варианты AMY2 европейского лося оказались сходными с вариантами AMY2 A и AMY2 B КРС (10, 11). Электрофорез церулоплазмина показал, что у лосей этот медьсодержащий a-2-гликопротеин плазмы крови мономорфен и соответствует варианту CP B КРС (8). Приводятся также результаты по определению полиморфизма белков эритроцитов и сыворотки крови у 19 одомашниваемых лосей (3). Показано, что локусы щелочной фосфатазы (ALP), эритроцитарной и сывороточной эстераз (ES) содержат по 3 аллеля, церулоплазмина (CP), карбоангидразы (CA) и амилазы (AMY) — по 2, а локусы гемоглобина (HB) и трансферрина (TF) мономорфны. При сравнении с белками КРС некоторые обнаруженные аллельные варианты можно определить как ALPO,ESO,CPA,CPВ,AMYB,AMYC, HBBи TFD.
Полиморфные системы белков молока. У трех одомашненных лосих из Печоро-Илычского государственного заповедника на электрофореграммах сывороточных белков было выявлено такое же число самостоятельных фракций, как у КРС, у которого первая по скорости миграции белковая фракция соответствует ?-лактоглобулину (LGB), вторая — ?-лактальбумину (LAA), а третья — иммуноглобулинам (IG). У лосих как в зоне ?-лактоглобулина, так и в зоне ?-лактальбумина было выявлено по одной окрашенной полосе. Ведущая по скорости миграции соответствовала по подвижности LGB A КРС, вторая — опережала LAA B коровы, третья, отнесенная к иммуноглобулинам, была выражена у лосих гораздо сильнее, чем у КРС.
При идентификации казеинов (?-CN) молока лосих образцы сравнили методом электрофореза в крахмальном геле с ?-CN B и ?-CN AB коровьего молока (12). Полиморфизма фракций и индивидуальные различия авторы не обнаружили. Первая по скорости миграции казеиновая фракция двигалась несколько медленнее ?-CN B коровы, вторая — быстрее обоих генетических вариантов ?-CN AB КРС. То есть условно генотип лосих по казеинам можно определить как ?-CN CC и ?-CN A’A’ (где ?-CN A’ — вариант белка с большей электрофоретической подвижностью, чем у ?-CN A КРС). Подобное отсутствие индивидуальных различий между особями европейского лося отмечали и другие авторы (13).
Изучение полиморфизма казеинов и белков сыворотки молока у 19 одомашниваемых лосей показало (3), что локусы ?-лактоглобулина (LGB), ?S-, ?- и ?-казеинов мономорфны. Была определена аминокислотная последовательность ?-казеина(14).
Белковые системы других тканей. Тканевые белки (трипсин и эластаза) выделили, в частности, из поджелудочной железы и охарактеризовали, определив аминокислотную последовательность и специфичность (15, 16). Доказано, что беременность у лосей можно выявлять тестом на специфичный B’-белок беременности у КРС (17). Определены также аминокислотные последовательности некоторых других белков: цитохрома b (CYB) из митохондрий с длиной молекулы 379 аминокислот (ген mt-Cyb) (18), ?-субъединицы фибриногена FIBA (синоним: фибринопептид А) — 19 аминокислот (ген Fga) (19), фибринопептида B (FIBB) — 21 аминокислота (20), мембранного рецептора меланоцитстимулирующего гормона (MSH-R) — 317 аминокислот (синонимы: рецептор меланотропина, рецептор меланокортина 1, MC1-R) (21), панкреатической рибонуклеазы (синонимы: РНКаза 1, РНКаза A) — 124 аминокислоты (22) и мембранного рецептора G-связывающего белка (ген GPR34, 790 п.н.) (23).
Полиморфные системы ДНК. Для рассмотрения особенностей внутривидовой дифференциации лося проведено молекулярно-генетическое исследование ДНК в популяциях вида в пределах его ареала в Евразии (14). Обследовались лоси (Alces alces), обитающие на разных территориях. Были изучены нуклеотидные последовательности 5'-периферического домена контрольного региона (CR) митохондриального генома, экзона 4 гена ?-казеина и экзона 2 гена MhcAlal-DRB1, относящегося к главному комплексу гистосовместимости. Наибольшее разнообразие CR выявлено у лосей из Якутии и Дальнего Востока. После филогенетического анализа генотипов по нуклеотидным последовательностям CR оказалось, что они представлены тремя кластерами, которые условно были названы азиатским, американским и европейским. Показатель нуклеотидного разнообразия CR у лося в Евразии равнялся 5,2, дивергенции между изученными последовательностями CR — 0,0117. Соответствующие значения для Якутии были весьма высокими и составляли 4,6 и 0,0103. Наиболее низкие величины (нуклеотидное разнообразие — 1,6, дивергенция нуклеотидных последовательностей CR — 0,0036) выявлены для кластера, объединившего последовательности CR американского типа с делецией размером 75 п.н., что указывает на относительно недавнее происхождение типа CR с делецией. Такой же тип найден у лосей в Якутии и на Дальнем Востоке, а ранее — у Alces alces americana в Канаде. Лоси в Европе и Западной Сибири несут CR только европейского типа, что соответствует географическому распространению особей с кариотипом 2n = 68. На территории Сибири и Дальнего Востока у лося отмечены три типа CR. В Якутии и на Дальнем Востоке до 25 % лосей несут генетические маркеры (CR митохондриального генома с делецией 75 п.н., а также MHC Alal-DRB1*5, МНС Alal-DRB1*7 и MHC Alal-DRB1*10), ранее описанные как характерные для американского лося. Это указывает на генетическую связь лосей в Северо-Восточной Азии и Америке. Время дифференциации вида, судя по данным о полиморфизме CR, составляет 0,075-0,150 млн лет.
K.J. Hundertmark с соавт. (24) изучили филогеографическую связь лосей (Alces alces) из разных регионов по митохондриальной ДНК (мтДНК) с целью выявить различия между отдельными популяциями. Частота изменения последовательности в пределах высокополиморфной области контрольного региона (CR) была низкой или средней во всех странах и структурировалась географически. Авторы показали, что степень генетических различий в митохондриальных геномах и структуры филогенетических древ идентифицируют Азию как центр распространения лосей, начиная с последнего ледникового периода. Одновременное расширение ареала лосей в регионе Якутия-Маньчжурия в Восточной Азии указывает на то, что это наиболее древняя зона обитания лосей и, возможно, источник поголовья, заселение которым Северной Америки началось примерно 15 000 лет назад. Изменение климата в течение последнего ледникового периода и заполнение водой Берингова пролива стало причиной обособления стад лосей на разных материках.
B.W. Murray с соавт. (25) проанализировали полиморфизм вариантов D-петли митохондриальной ДНК у 15 видов копытных животных с помощью полимеразной цепной реакции (ПЦР) с определением доли митохондриальной ДНК (мтДНК) гаплотипов. ДНК выделяли из образцов крови лосей (Alces alces), карибу (Rangifer tarandus), оленей (Odocoileushemionushemionus, O. h. columbianus, O. virginianus), вапити (Cervuselaphus), вилорогой антилопы (Antilocapraamericana), овец (Ovis canadensis, O. dalli, O. aries, O. musimon), коз (Oreamnosamericanus, Caprahircus), крупного рогатого скота (Bos taurus) и бизонов (Bison bison). Предварительные исследования выявили у всех копытных, кроме представителей вида оленей (Odocoileus), специфические варианты в области D-петли митохондриального генома.
|
1. Частота аллельных вариантов гена DRB1 у лосей шведской и канадской популяции (цит. по26) |
||
|
Аллель |
Шведская популяция (n = 30) |
Канадская популяция (n = 19) |
|
DRB1*1 |
0,28 |
0 |
|
DRB1*2 |
0,38 |
0 |
|
DRB1*3 |
0,05 |
0,18 |
|
DRB1*4 |
0,12 |
0 |
|
DRB1*5 |
0 |
0,58 |
|
DRB1*6 |
0,13 |
0 |
|
DRB1*7 |
0 |
0,21 |
|
DRB1*8 |
0,02 |
0 |
|
DRB1*9 |
0,02 |
0 |
|
DRB1*10 |
0 |
0,03 |
S. Mikko и L. Andersson (26) изучили гены класса II главного комплекса гистосовместимости в образцах крови и тканей у 30 европейских (Швеция: Lycksele и Laisdalen, округ Lappland; Robertsfors, округ Vasterbotten; Sala, округ Uppland; Tranas, округ Smaland) и 19 североамериканских (Канада: национальные парки Yoho, Terra Nova, Jasper, Banff, Glacier, Kootenay и Prince Al-bert) лосей. Главный комплекс гистосовместимости (MHC) у всех животных кодирует гены поверхностных белков, представляющих собой внеклеточные связывающие пептиды Т-лимфоцитов. Высокий полиморфизм MHC многократно подтвержден и поддерживается компенсирующим отбором. Авторы сообщают, что как европейские, так и североамериканские лоси (Alces alces) характеризуются очень низким генетическим разнообразием в классе II DRB MHC. Наблюдаемый полиморфизм ограничивался шестью аминокислотными заменами в рецепторном участке пептида; четыре из них были распространены в обеих популяциях.
Аллельные фрагменты одного из локусов были обозначены, как DRB1. Фрагменты амплифицировали с помощью ПЦР с использованием специфических праймеров для экзона 2 гена DRB КРС, который кодирует половину пептида DR, связывающий участок и участок локализации большинства полиморфных кодонов в DRB-генах млекопитающих (27). С помощью SSCP анализа (single strand conformation polymorphism — анализ конформации одноцепочечных фрагментов) авторы обнаружили 7 и 4 аллели DRB1 у лосей соответственно шведской и канадской популяций, и только один аллель был общим для всех (табл. 1) (26). При секвенировании оказалось, что полиморфизм фрагментов ограничивается десятью нуклеотидными заменами, или шестью аминокислотными заменами в структуре белка (рис. 1).
|
11 |
57 |
71 |
74 |
85 |
86 |
|
|
+ |
+ |
+ |
+ |
- |
+ |
|
|
DRB1*1 |
GCT |
GAC |
AGG |
GAG |
GTC |
GGT |
|
Ala |
Asp |
Arg |
Glu |
Val |
Gly |
|
|
DRB1*2 |
CA- |
--- |
--- |
--- |
--- |
--- |
|
His |
- |
- |
- |
- |
- |
|
|
DRB1*3 |
CA- |
TC- |
G-- |
-C- |
--T |
AT |
|
His |
Ser |
Gly |
Ala |
- |
Ile |
|
|
DRB1*4 |
CA- |
TC- |
--- |
--- |
--T |
AT |
|
His |
Ser |
- |
- |
- |
Ile |
|
|
DRB1*5 |
CA- |
--- |
G-- |
-C- |
--- |
--- |
|
His |
- |
Gly |
Ala |
- |
- |
|
|
DRB1*6 |
CA- |
--- |
-C- |
-C- |
--- |
--- |
|
His |
- |
Thr |
Ala |
- |
- |
|
|
DRB1*7 |
CA- |
TC- |
--- |
--- |
--- |
--- |
|
His |
Ser |
- |
- |
- |
- |
|
|
DRB1*8 |
CA- |
--- |
-C- |
-C- |
--T |
AT |
|
His |
- |
Thr |
Ala |
- |
Ile |
|
|
DRB1*9 |
CA- |
TC- |
G-- |
-C- |
--- |
--- |
|
His |
Ser |
Gly |
Ala |
- |
- |
|
|
DRB1*10 |
CA- |
--- |
G-- |
-C- |
--T |
AT |
|
His |
- |
Gly |
Ala |
- |
Ile |
Рис. 1. Полиморфные кодоны десяти аллелей гена DRB1 лосей шведской и канадской популяции и соответствующие им аминокислотные остатки (цит. по 26). Перваястрока — номера позиций кодонов, вторая —наличие или отсутствие замены в центральномнуклеотиде кодона.
Относительные частоты неповторяющихся и повторяющихся замен у аллелей гена DRB1 значительно различались в кодонах связывающего участка пептида (dN = 0,113±0,032; dS = 0; P < 0,001). Это свидетельствует в пользу утверждения, что накопление разнообразия DRB1 обеспечивается положительным естественным отбором. К примеру, аллели 1 и 3 различались соответственно одной и восемью повторяющимися заменами в пяти кодонах, обеспечивающих связывающие функции пептида. Изучение части гипервариабельного участка (D-петля) мтДНК, проведенное для оценки времени расхождения европейской и северо-американской форм лосей с помощью SSCP и анализа последовательности ПЦР-фрагментов, выявило соответственно 2 и 7 типов в образцах мтДНК шведского и канадского лося. Удивительное различие между последовательностями D-петель этих образцов заключалось в том, что у канадского лося она содержала вставку размером 75 п.н. В 9 аллелях обнаружили в общей сложности 28 полиморфных участков, образующихся из-за транзитных мутаций (табл. 2). Статус европейского и канадского подвидов лося подтверждается также четкой дихотомией нуклеотидных последовательностей D-петель у обеих популяций (рис. 2) (26).
|
2. Нуклеотидные последовательности D-петель мтДНК шведских и канадских лосей (цит. по 26) |
||||
|
Последовательность |
Нача-ло |
Позиция |
||
|
11122333 206889124 3050666829 |
3334444444 5570111134 1453123551 |
44445555 45592223 88942356 |
||
|
1 |
S |
GATAACTTTA |
CTGCTCGCTC |
GCTAATTG |
|
2 |
S |
–––––T–––– |
–C–T–––––T |
–T–––––– |
|
3 |
C |
AG–GGT–C–G |
––ATC–ATCT |
ATC–GCC– |
|
4 |
C |
AG–GGT–C–G |
––ATC–ATCT |
ATCGGCCA |
|
5 |
C |
AGCGGT–C–G |
T–ATCTATCT |
ATC–G–C– |
|
6 |
C |
AG–GGT–C–G |
––ATC–ATC– |
ATC–GCC– |
|
7 |
C |
AG–GGT–C–G |
––ATC–ATCT |
AT––GCC– |
|
8 |
C |
AG–GGTCC–G |
––ATC–A–CT |
ATC–GCC– |
|
9 |
C |
AG–GGT–CCG |
––ATC–ATCT |
ATC–GCC– |
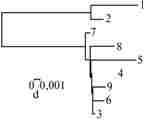
Рис. 2. Филогенетическое древо европейской и канадской популяции лосей, составленное на основании анализа последовательностей D-петли мтДНК (цит.по 26): 1 и 2 —шведские лоси; 3-9 —канадские лоси; d —генетическое расстояние.
Был сделан вывод (26), что лоси утратили разнообразие MHC генов в течение короткого периода еще до образования шведского и канадского подвидов. Анализ мтДНК показал, что эти подвиды отделились друг от друга около 100 000 лет назад, то есть жизнеспособные популяции лосей с очень низким полиморфизмом генов MHC существуют длительное время. Положительная селекция на полиморфизм и рекомбинации внутри экзонов началась только после предполагаемого периода расхождения этих подвидов Alces alces. Ограниченный полиморфизм генов главного комплекса гистосовместимости был показан позже у шведских лосей (28).
Пять микросателлитных последовательностей были изучены H.G. Broders с соавт. у канадских лосей (29). Сравнения частот аллелей у животных из 11 регионов показало, что в Северной Америке существует не менее семи генетически различных групп животных (P < 0,05). Выявлена средняя гетерозиготность поголовья — около 33 % (от 22 до 41 %). Был проведен анализ генетических расстояний по М. Nei (30). Снижение гетерозиготности наблюдали в одном случае (n = 3; естественное заселение), и оно составляло 14-30 %. Общее снижение гетерозиготности вследствие влияния двух особей-предков (естественное заселение) равнялось 46 %. При этом уменьшение генетической изменчивости не было связано с любыми обнаруженными фенотипическими девиансами (deviances) и, вероятно, объяснялось образованием изученного стада из небольшого числа предков-основателей.
Высокоповторяющиеся последовательности ДНК часто используют для идентификации вида тканей животных в судебной практике при расследовании случаев незаконной коммерческой деятельности (торговля мясом и браконьерство) (31). Так, были изучены образцы тканей оленя (Odocoileus virginianus), лося (Alces alces) и черного медведя (Ursus ame-ricanus). После обработки ДНК сайтспецифическими эндонуклеазами рестрикции, гель-электрофореза в агарозе и последующей окраски бромистым этидием образуется уникальный для каждого вида животных набор фрагментов ДНК. ДНК-дактилоскопия использовалась также в расследовании 40 случаев браконьерства в отношении оленей (Odocoileus virgini-anus) и лосей (Alces alces) (32). Тотальную ДНК выделяли из образцов крови и тканей. Всего обследовали 27 оленей и 19 лосей. Для каждого животного были получены индивидуальные спектры распределения фрагментов ДНК.
Микросателлитные последовательности использовались также при изучении попупяционной генетики лосей (33). Был разработан способ определения пола у лосей (Cervus elaphus canadensis и Alces alces) и оленей (Odocoileus virginianus) с помощью специального протокола ПЦР (34). Метод позволил одновременно амплифицировать закрытый участок гена, определяющего пол (Sry) и расположенного на Y-хромосоме, а также область гена Fmr-1 (Fragile X mental retardation).
Наследственные болезни и аномалии у лосей. Вопрос о наследственных болезнях у лосей изучен недостаточно. Некоторые нетипичные заболевания лосей, вызванные измененными белками, описаны в работе H.J. Huson и G.M. Happ (35). Проявление наследственных аномалий зафиксировано только у одомашниваемых лосей, возможно, из-за большей доступности таких животных для обследования. Единичный случай рождения лосят с клыками был зафиксирован в 1975 году на опытной лосеферме Печоро-Илычского заповедника (36) у двух состоящих в родстве лосих. Было получено по лосенку-самцу с клыками на верхней челюсти: у первого — один на правой ветви челюсти (на мягком основании, длина около 9 мм, по форме похож на клык собаки; на 3-и сут отпал во время поения лосенка из бутылки с соской), у второго — два (по одному на каждой ветви верхней челюсти), прочно фиксированные в костных альвеолах. У других 450 выращенных на ферме лосей и при изучении более 700 черепов диких животных, собранных на сопредельной с заповедником территории, подобную аномалию не наблюдали.
На ГНИУКО «Сумароковская лосеферма» (организована в 1963 году) в 2004 и в 2007 годах были зафиксированы случаи рождения бесшерстных лосят (все — особи женского пола от одной матери). Возможно, что гипотрихоз у лосят, как и у других видов животных, сцеплен с полом и проявляется в гомозиготном состоянии. К сожалению, в описанном случае подробный генетический анализ и пожизненное наблюдение за выжившими бесшерстными лосихами не проводили.
Таким образом, дальнейшее изучение и развитие генетики и селекции лосей необходимо как с точки зрения популяционного анализа, так и в связи с проблемой одомашнивания. Еще в 1869 году русский академик А.Ф. Миддендорф (37) писал: «Даже цивилизованная Европа в новейшее время тщетно пыталась обратить в полезное домашнее животное лося, который, несомненно, мог бы принести огромную пользу. Правительству нашему следовало бы всеми силами содействовать обращению лося в домашнее животное. … Велика была бы заслуга, велика была бы и слава …». Лось — сильное и нетребовательное животное, представляющее очень большой интерес для одомашнивания (38). По типу нервной деятельности он хорошо поддается приручению. Известно о попытках одомашнивания в Скандинавии. Однако до настоящего времени лоси не относятся к числу домашних животных. Очевидно, одна из причин — недостаточная универсальность этого вида. Он узко приспособлен к лесной и таежной зоне. Зубы лося позволяют поедать побеги и листья деревьев, но он практически не может перетирать траву. У лося ослаблена терморегуляция, при физической работе он быстро перегревается и в этом отношении не может конкурировать с северным оленем и лошадью.
Литература
1. Боескоров Г.Г., Шелчкова М.В., Ревин Ю.В. Кариотип лося (Alcesalces L.) из северо-восточной Азии. Докл. РАН, 1993, 329(4): 506-508.
2. БоескоровГ.Г. Хромосомные различия у лосей (Alcesalces L., Artiodactyla, Mammalia). Генетика, 1997, 33(7): 974-978.
3. Семенов В.А., Сороковой П.Ф., Кузьминов И.П. и др. Отчет отдела лосеводства Костромской сельскохозяйственной опытной станции за 1977-1982 г.г. Раздел 4. Изучить предполагаемый наследственный полиморфизм эритроцитов крови и молока лосей в связи с адаптационными способностями к экологическим условиям обитания. Кострома, 1982.
4. Методические рекомендации по исследованию и использованию иммуногенетических маркеров для контроля происхождения крупного рогатого скота /Под ред. П.Ф. Сорокового. Дубровицы, 1981.
5. Джурович В.М., Михайлов А.П. Проблема одомашнивания лося и использования продуктов лосеводства. Аграрная наука Евро-Северо-Востока, 2000, 2: 98-101.
6. Braend M. Studies on blood and serum groups in the elk (Alces alces). Ann. N.-Y. Acad. Sci., 1962, 3, 97(6): 296-305.
7. Шубин П.Н. Генетика трансферринов северного оленя и европейского лося. Генетика, 1969, V(1): 37-41.
8. Шубин П.Н., Ефимцева Э.А. Биохимическая и популяционная генетика северного оленя. Л., 1988.
9. Aschauer H., Wiesner H., Braunitzer G. Intrinsic oxygen affinity: the primary structure of a ruminantia hemoglobin: methionine in betaNA2 of a pecora, the Northern elk (Alces alces alces). Hoppe-Seyler's Z. Physiol. Chem., 1984, 365(11): 1323-1330.
10. Ebertus R. Untersuchungen ber Amylasepolymorphismus in Serum des Rindes. Fortpflanz., Bezam. Aufzucht Haustiere., 1968, 4: 289-295.
11. Gasparski J., Stevens R.W.C. Bovine serum amylase isozymes in several breeds of domestic cattle. Canad. J. Genet. Cytol., 1968, 10: 148-151.
12. Шубин П.Н., Турубанов М.Н., Матюков В.С. Электрофоретические исследования белков молока северного оленя и европейского лося. Журн. общ. биол., 1971, XXXII(6): 746-750.
13. Ryman N., Reuterwall C., Nygren K. e.a. Genetic variation and differentiation in Scandinavian moose (Alces alces): are large mammals monomorphic? Evolution, 1980, 34: 1037-1049.
14. Удина И.Г., Данилкин А.А., Боескоров Г.Г. Генетическое разнообразие лося (Alcesalces L.) в Евразии. Генетика, 2002, 38(8): 1125-1132.
15. Lievaart P.A., Stevenson K.J. The isolation of trypsin and elastase from moose pancreas (Alces alces) by affinity chromatography on lima-bean protease inhibitor-sepharose resin. Can. J. Biochem., 1974, 52(7): 637-644.
16. Stevenson K.J., Voordouw J.K. Characterization of trypsin and elastase from the moose (Alces alces). I. Amino acid composition and specificity towards polypeptides. Biochim Biophys. Acta, 1975, 386(1): 324-331.
17. Haigh J.C., Dalton W.J., Ruder C.A. e.a. Diagnosis of pregnancy in moose using a bovine assay for pregnancy-specific protein B. Theriogenology, 1993, 40(5): 905-911.
18. Randi E., Mucci N., Pierpaoli M. e.a. New phylogenetic perspectives on the Cervidae (Artiodactyla) are provided by the mitochondrial cytochrome b gene. Proc. R. Soc. Lond. B. Biol. Sci., 1998, 265: 793-801.
19. Blombaeck B., Blombaeck M. Chemotaxonomy and Serotaxonomy. N.-Y., 1968: 3-20.
20. Mross G.A., Doolittle R.F. Amino acid sequence studies on artiodacty fibrinopeptides. Arch. Biochem. Biophys., 1967, 122: 674-684.
21. Klungland H., Roed K.H., Nesbo C.L. e.a. The melanocyte-stimulating hormone receptor (MC1-R) gene as a tool in evolutionary studies of artiodactyls. Hereditas, 1999, 131(1): 39-46.
22. Leijenaar van den Berg G., Beinteмa J.J. The amino acid sequences of reindeer, moose and fallow deer pancreatic ribonucleases. FEBS Lett., 1975, 56(1): 101-107.
23. Schulz A., Schoneberg T. The Structural Evolution of a P2Y-like G-proteincoupled Receptor. J. Biol. Chem., 2003, 278(3): 35531-35541.
24. Hundertmark K.J., Shields G.F., Udina I.G. e.a. Mitochondrial phylogeography of moose (Alces alces): late pleistocene divergence and population expansion. Mol. Phylogenet. Evol., 2002, 22(3): 375-387.
25. Murray B.W., McClymont R.A., Strobeck C. Forensic identification of ungulate species using restriction digests of PCR-amplified mitochondrial DNA. J. Forensic Sci., 1995, 40(6): 943-951.
26. Mikko S., Andersson L. Low major histocompatibility complex class II diversity in European and North American moose. PNAS USA, 1995, 92: 4259-4263.
27. Brown J.H., Jardetzky T., Saper M.A. e.a. A hypothetical model of the foreign antigen binding site of class II histocompatibility molecules. Nature, 1988, 332(6167): 845-850.
28. Ellegren H., Mikko S., Wallin K. e.a. Limited polymorphism at major histocompatibility complex (MHC) loci in the Swedish moose A. alces. Mol. Ecol., 1996, 5(1): 3-9.
29. Broders H.G., Mаhoney S.P., Montevecchi W.A. e.a. Population genetic structure and the effect of founder events on the genetic variability of moose, Alces alces, in Canada. Mol. Ecol., 1999, 8(8): 1309-1315.
30. Nei M. Molecular evolutionary genetics. N.Y., 1987.
31. Guglich E.A., Wilson P.J., W h i t e B.N. Forensic application of repetitive DNA markers to the species identification of animal tissues. J. Forensic Sci., 1994, 39(2): 353-361.
32. Guglich E.A., Wilson P.J., White B.N. Application of DNA fingerprinting to enforcement of hunting regulations in Ontario. J. Forensic Sci., 1993, 38(1): 48-59.
33. Lenney C., Serfass W.T.L., Cogan R. e.a. Microsatellite variation in the reintroduced Pennsylvania elk herd. Mol. Ecol., 2002, 11(8): 1299-1310.
34. Wilson P.J., White B.N. Sex identification of elk (Cervus elaphus canadensis), moose (Alces alces), and white-tailed deer (Odocoileus virginianus) using the polymerase chain reaction. J. Forensic Sci., 1998, 43(3): 477-482.
35. Huson H.J., Happ G.M. Polymorphisms of the prion protein gene (PRNP) in Alaskan moose (Alces alces gigas). Anim. Genet., 2006, 37(4): 425-426.
36. Кожухов М.В. Редкий случай рождения лосят с клыками. Мат. 3-го Междунар. симп. по лосю. Сыктывкар, 1990: 34.
37. Миддендорф А.Ф. Путешествие на север и восток Сибири. Ч. II, отдел. 5. Сибирская фауна. СПб, 1869.
38. Куликов Л.В. История и методология зоотехнической науки. М., 2001.
PRIMARY GENETIC CHARACTERISTICS OF WILD AND
DOMESTICATED ELKS (review)
A.V. Baranov, O.V. Golubev, N.S. Marzanov, N.A. Popov
On the basis of the foreign and native data the authors considered the cytogenetic characteristics,the systems of groups and polymorphous proteins of the blood, the polymorphous systems ofmilk proteins, others tissues, DNA polymorphism (the alleles of incompatibility genes,mitochondrial DNA, microsatellite sequences); also the data are presented about hereditarydiseases and anomalies in elks.
Key words: genetics, biological variety, types, genes, genetic markers.




